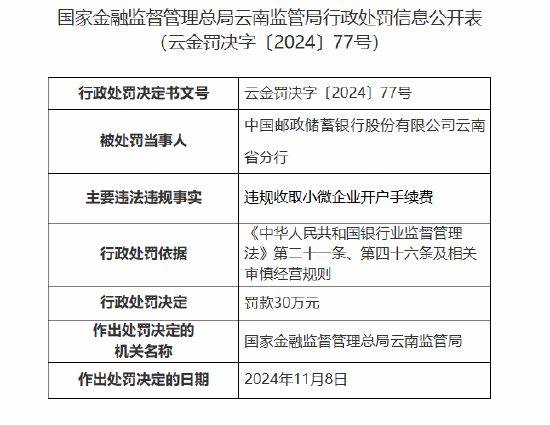
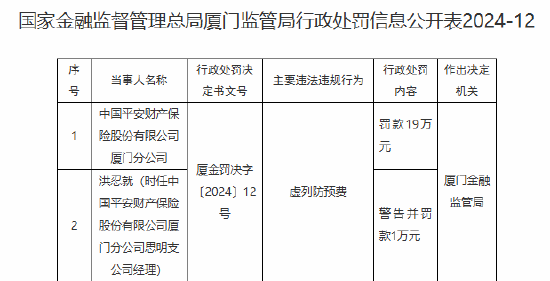
智通财经APP讯,艾美疫苗(06660)发布公告,集团近日获得中国食品药品检定研究院关于无血清迭代狂犬病疫苗III期临床试验血清抗体检测结果的通知,截止目前,集团无血清迭代狂犬病疫苗III期临床试验数据已完成揭盲及统计分析工作。研究结果显示,集团研制的无血清迭代狂犬病疫苗具有良好的免疫塬性,且安全性良好,达到临床预设目标。
无血清迭代狂犬病疫苗,与目前含有血清的Vero细胞狂犬病疫苗和含有血清的人二倍体狂犬病疫苗完全不同,是一款迭代升级的产品。疫苗产品中的动物血清残留是导致疫苗接种人群产生过敏等不良反应的重要因素之一,集团研发的无血清迭代狂犬病疫苗,不含有动物血清,显著提高了安全性,降低了不良反应的概率。截至目前,全球市场上尚未有无血清狂犬病疫苗获批上市,该产品有望成为首个上市产品。

集团已建设完成具备生产能力且满足国际化标准的无血清迭代狂犬病疫苗生产车间。集团作为全球第二大狂犬疫苗供应商,引领全球狂犬病疫苗的深度技术迭代升级,在无血清迭代狂犬病疫苗产品上市后,将为市场提供质量更好,安全性更高的狂犬病疫苗产品,实现行业新质生产力。

目前集团已完成上市注册的前期工作,已在GMP车间进行符合上市规模及质量要求的工艺验证,且药品注册前置检验结果符合质量标准,正在积极推进临床总结报告的获得。根据国家药品注册管理相关法规,申报企业在获得疫苗临床研究总结报告,并在GMP车间进行符合上市规模及质量要求的工艺验证后,即可向国家药品监督管理局(NMPA)递交药品上市注册申请。集团将尽快申请提交上市注册。
【免责声明】本文仅代表作者本人观点,与和讯网无关。和讯网站对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。请读者仅作参考,并请自行承担全部责任。邮箱:[email protected]